1. Las combinaciones del oxígeno con los distintos elementos de la tabla periódica dan compuestos decarácter ácido, básico o anfótero (compuestos con ambas características, dependiendo del medio).
Justifica la variación periódica de este carácter, que se muestra en la tabla.
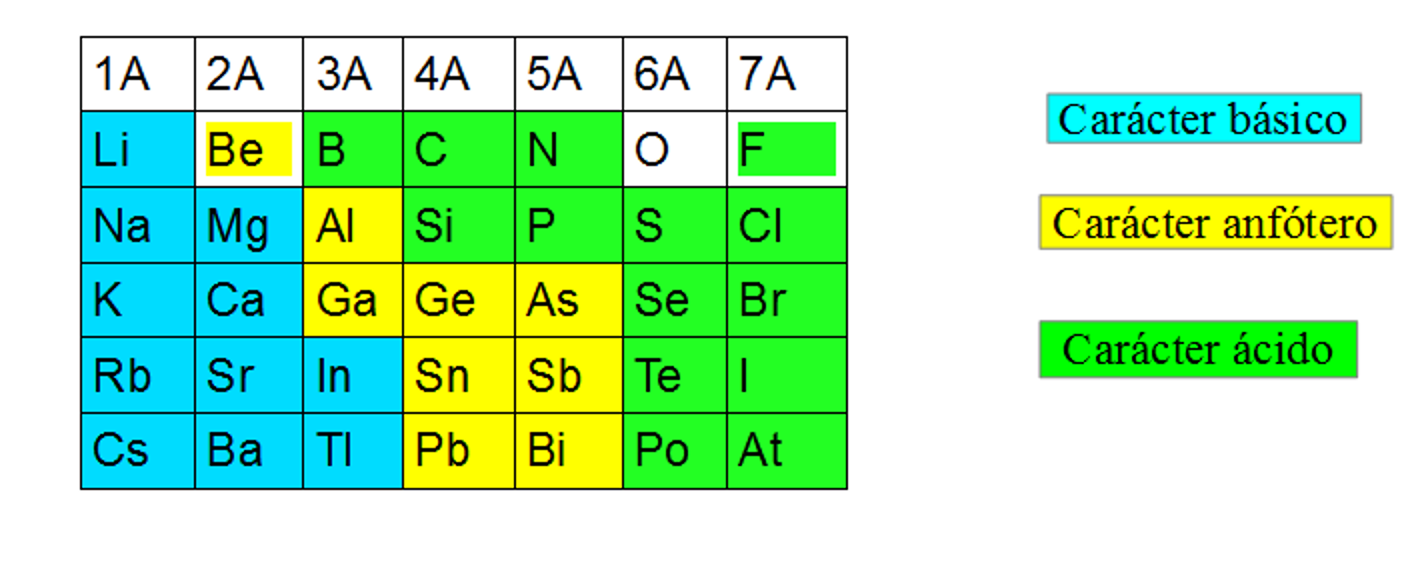
Segundo paso: Analizar el carácter ácido o básico de los óxidos de los elementos que se muestran enla tabla.
Teniendo en cuenta su electronegatividad, puede decirse que todos los elementos del grupo 1A formanóxidos iónicos, ya que, para todos ellos el potencial de ionización es lo suficientemente bajo como para quepierdan su electrón de valencia al combinarse con el oxígeno.
De forma similar todos los elementos de los grupos 6A y 7A forman óxidos covalentes, ya que, todosellos presentan una electronegatividad muy parecida a la del oxígeno.
En los demás grupos, la electronegatividad disminuye al aumentar el número atómico; por eso, amedida que descendemos, los distintos elementos tienden a formar óxidos iónicos.
Como la electronegatividad se intensifica en cada periodo a medida que se eleva el número atómico(hacia la derecha), puede establecerse una diagonal para separar los óxidos iónicos de los covalentes.
En los grupos 2A a 5A hay uno, dos o tres elementos que tienen un comportamiento intermedio. Susóxidos serán ácidos o básicos dependiendo de las circunstancias, son los óxidos anfóteros.



