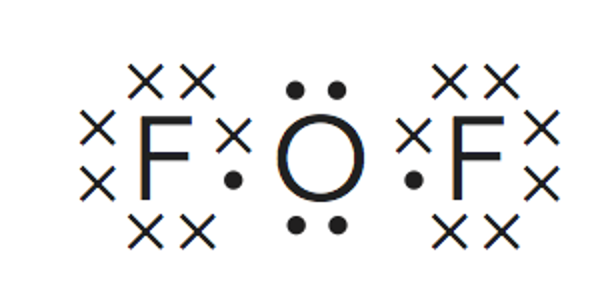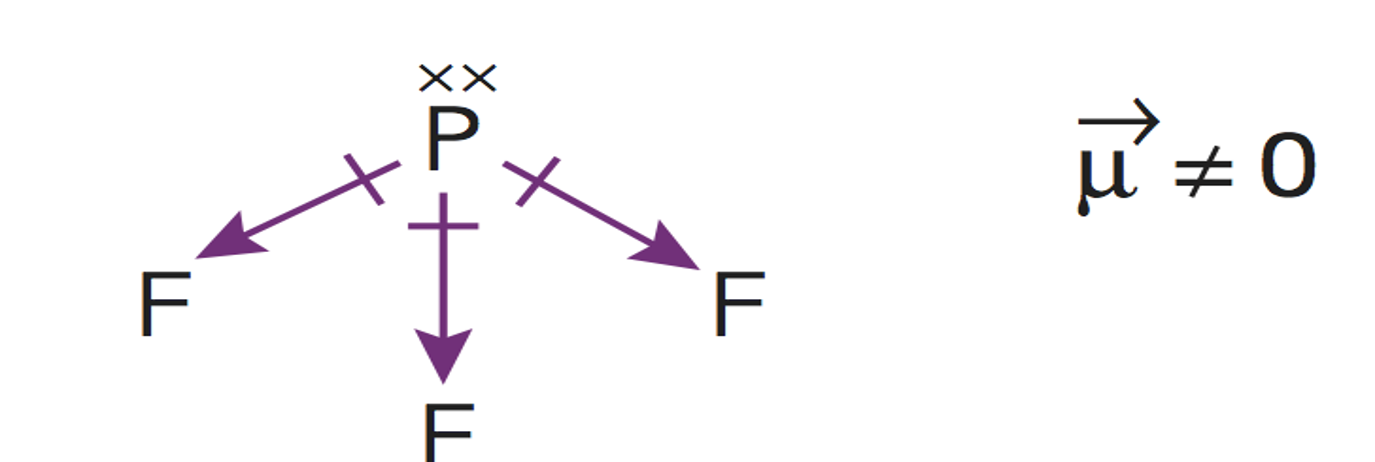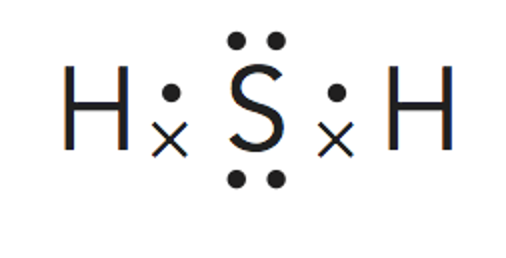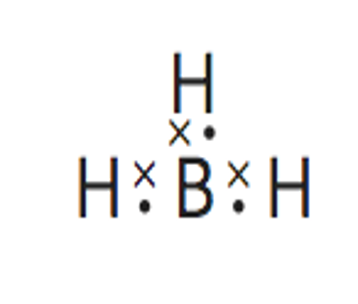Teoría de repulsión de los pares de electrones de la capa de valencia.
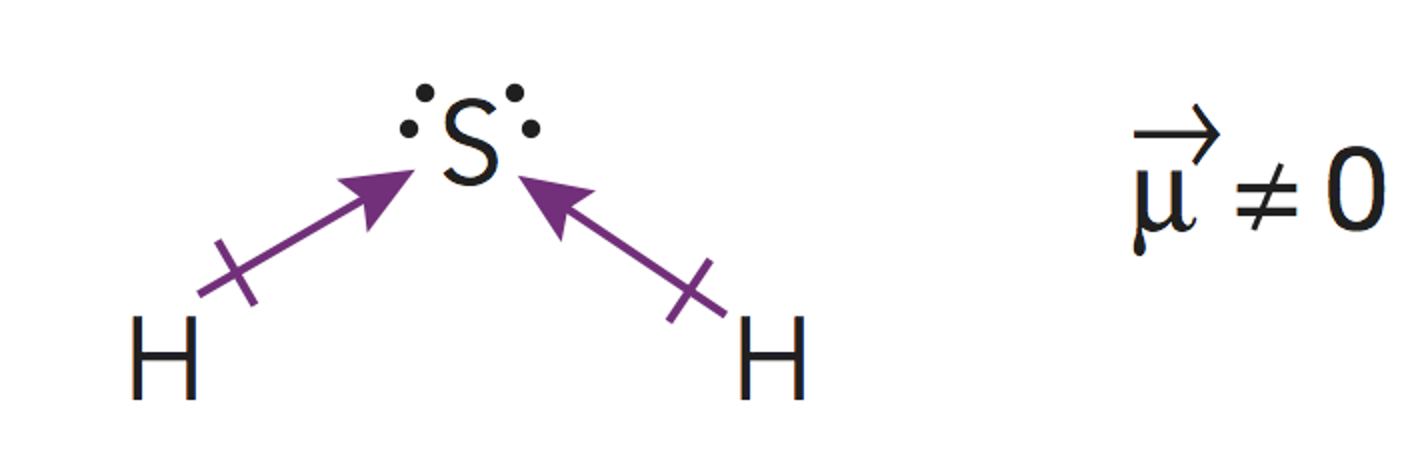
Los ángulos de enlace disminuyen a medida que aumentan el número de pares de electrones noenlazantes. Los pares enlazantes son atraídos por los dos núcleos de los átomos enlazados. Los no enlazantes sonatraídos por un solo núcleo, por lo que pueden extenderse más en el espacio. Los pares de electrones no enlazantesejercen fuerzas de repulsión sobre los pares de electrones adyacentes y tienen a comprimir los ángulos de enlaceentre los pares de electrones enlazantes (tal como se verá más adelante en un problema sobre los compuestos delxenón).
Teoría del enlace de valencia
Esta teoría explica los enlaces covalentes en términos de orbitales atómicos. Supone que los electrones deuna molécula ocupan orbitales atómicos de los átomos individuales. Establece que una molécula se forma a partir dela reacción entre los átomos, los cuales al unirse aparean sus electrones y solapan sus orbitales.

Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes
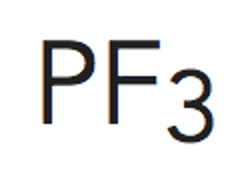
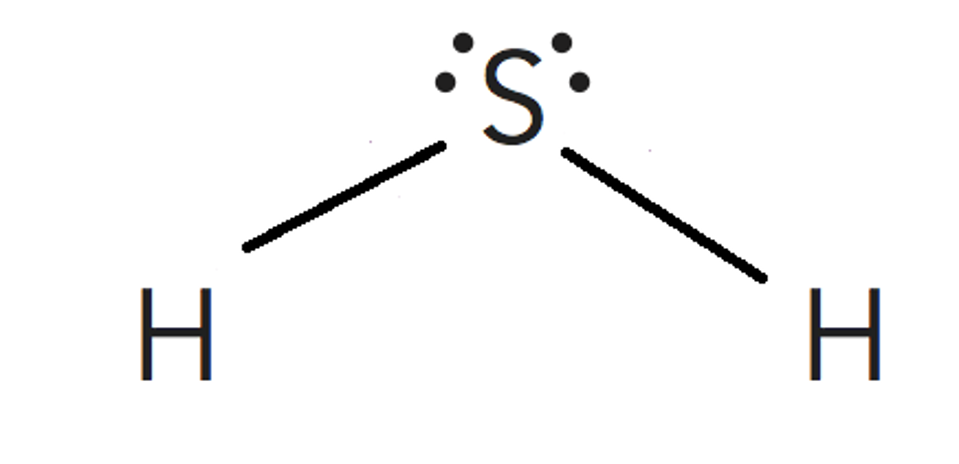
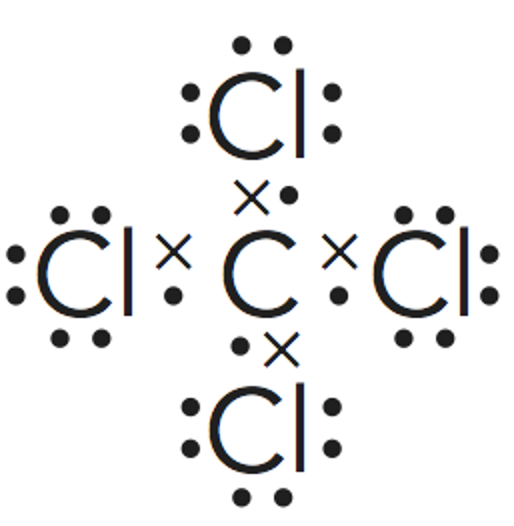
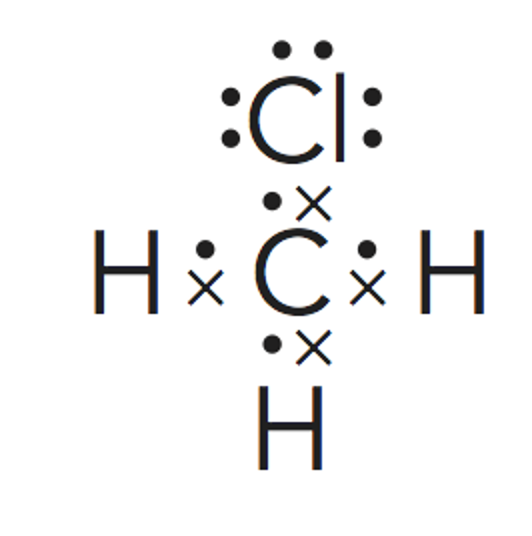
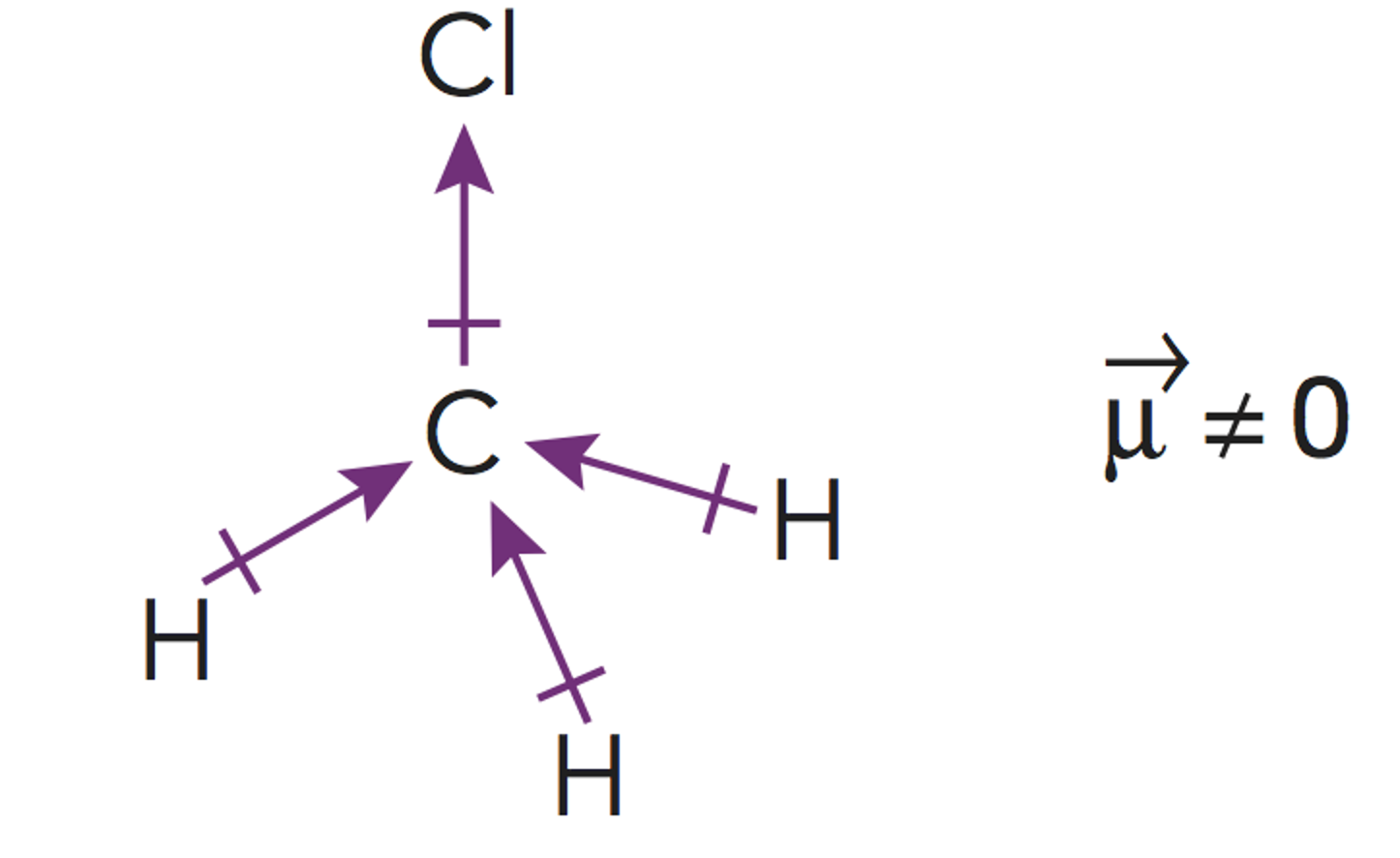
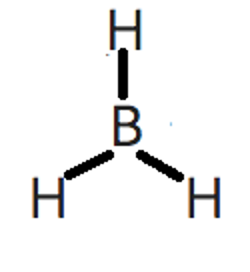
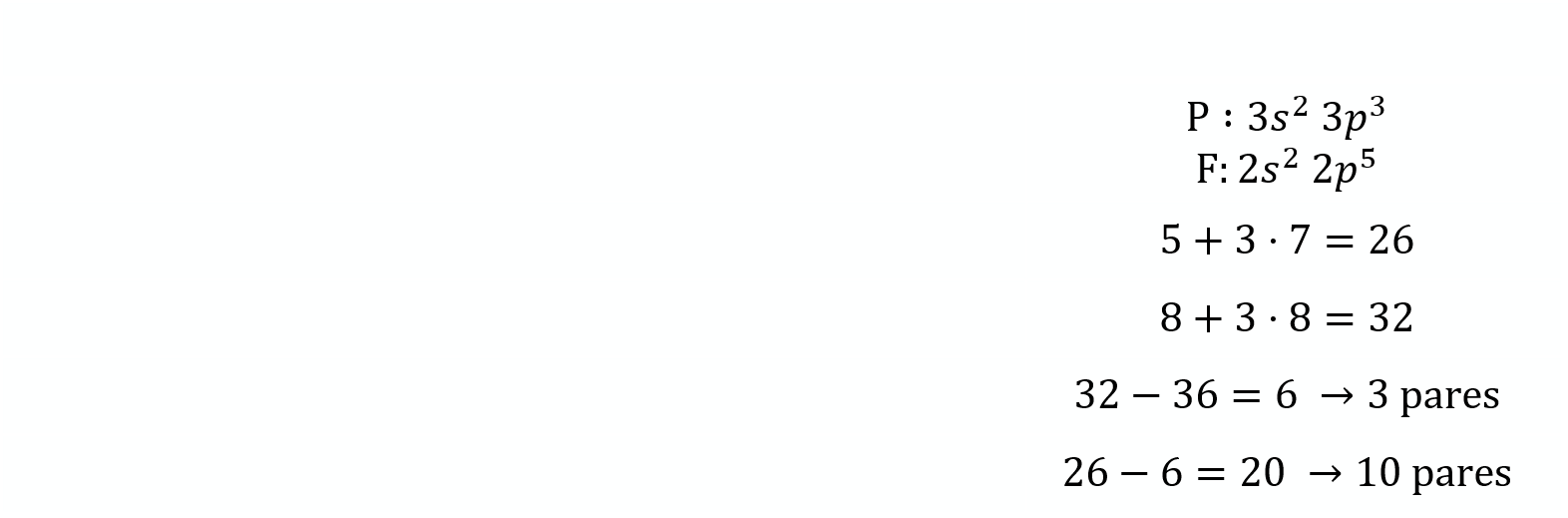
Paso 3. Obtener la representación de Lewis de la molécula.
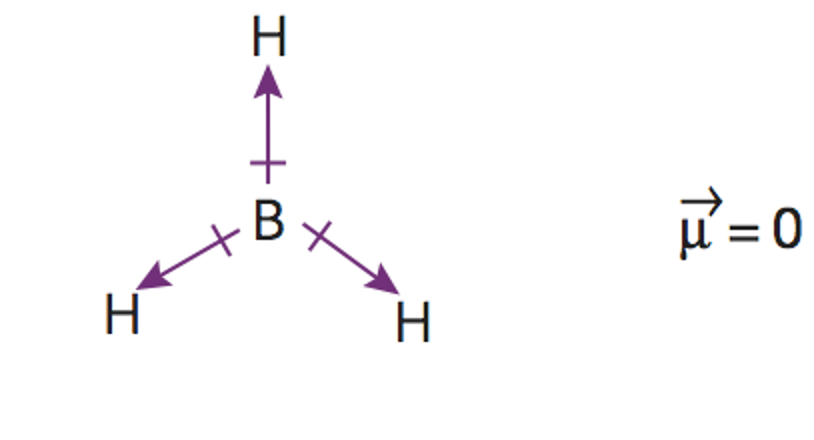
Según predice la estructura de Lewis al existir 3 pares de electrones enlazantes se tiene unaestructura triangular plana para situar los átomos de flúor. No se tienen en cuenta los electrones libres en estecaso.
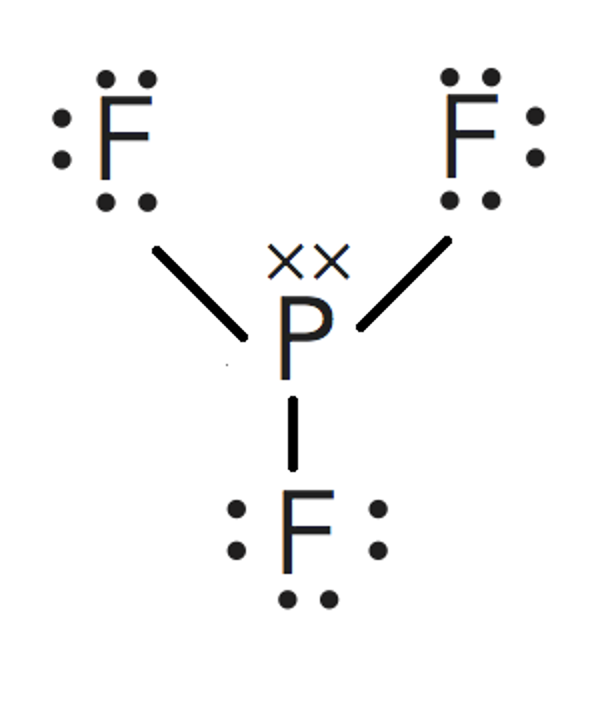
Según la Teoría de repulsión de los pares electrónicos de la capa de valencia, la repulsión entre parno enlazante y par no enlazante > repulsión entre par no enlazante y par de enlace > repulsión entre par deenlace y par de enlace, por lo que la estructura se cierra, haciendo los ángulos menores que los del tetraedro.
Por lo tanto la geometría de la molécula será piramidal trigonal.

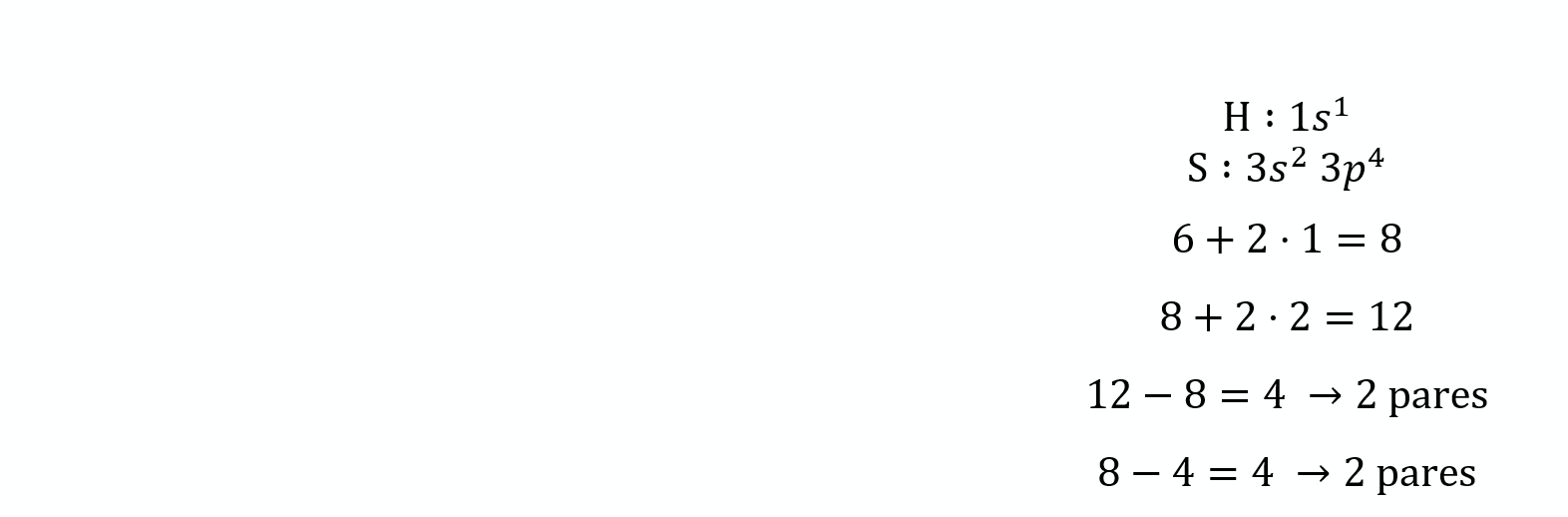
Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes
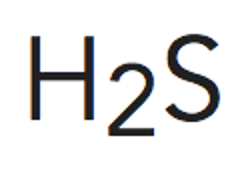

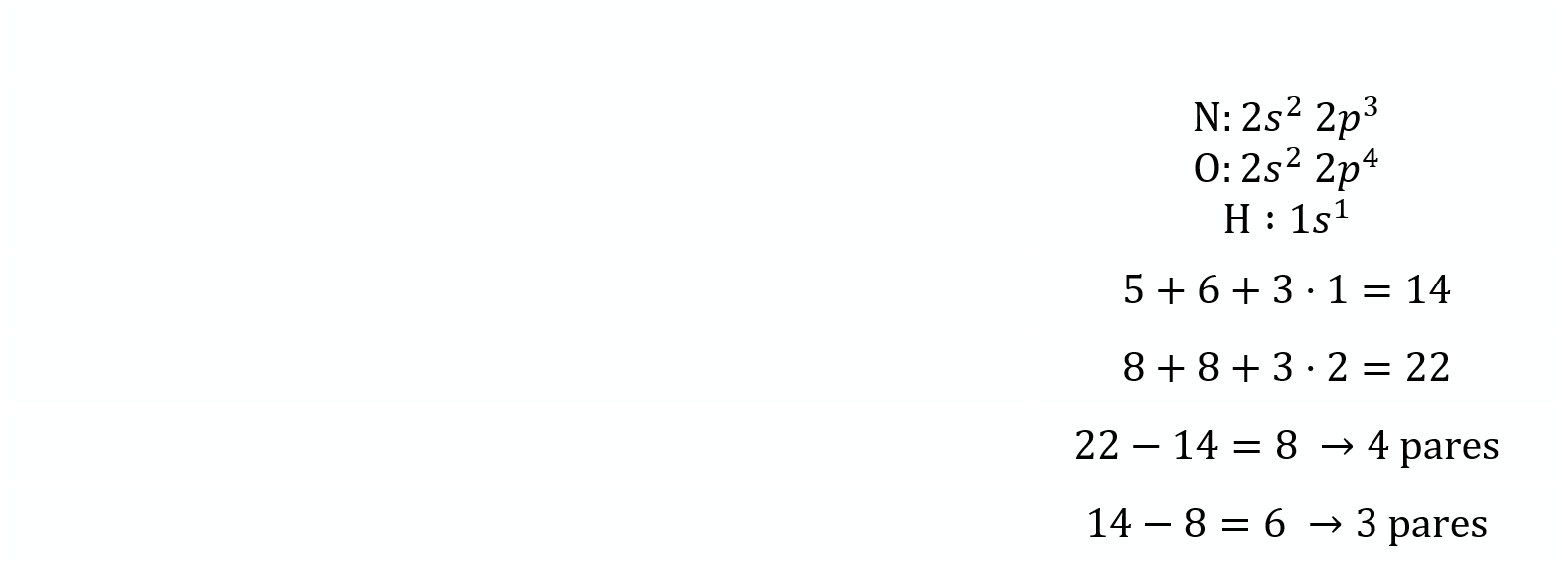
Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes
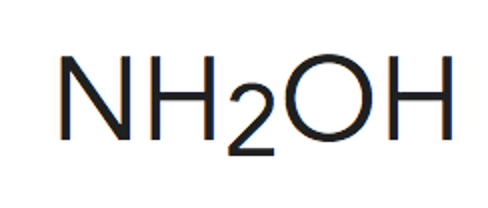
Paso 3. Obtener la representación de Lewis de la molécula.
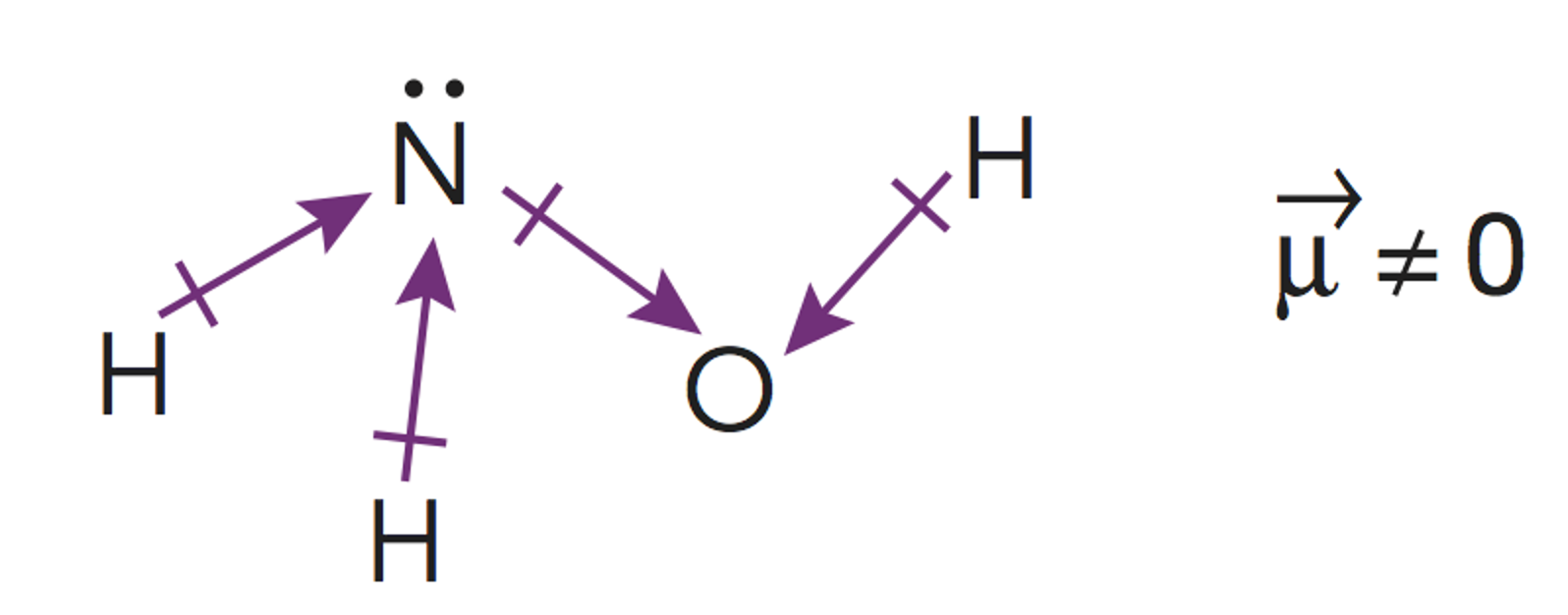
Para la hidroxilamina son posibles dos estructuras de Lewis cumpliendo la cantidad de pares enlazantesy no enlazantes.
Para poder decidir cuál de ellas es la correcta es necesario definir lo que se entiende por carga formalsobre un átomo.
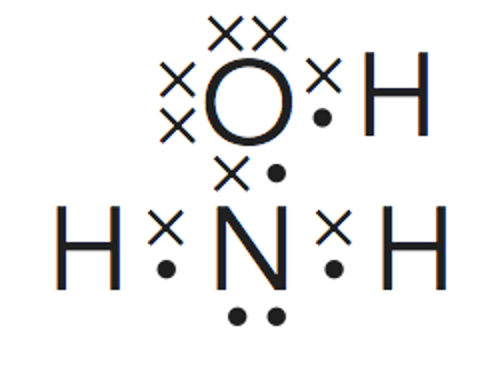
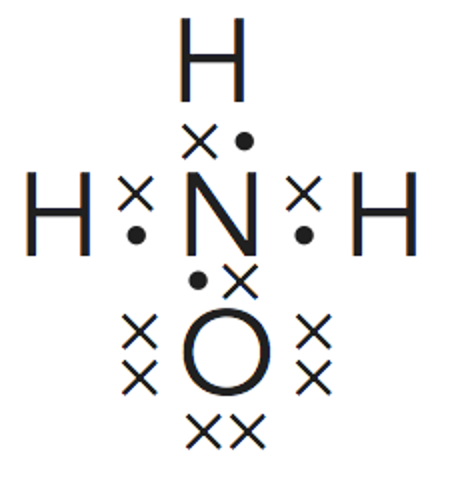
Paso 4. Estudio de la geometría desde el punto de vista de la TRPECV.
Para estudiar la molécula de hidroxilamina a través de la TRPECV habrá que tener en cuenta los paresde electrones libres alrededor del átomo central (nitrógeno) y de un átomo lateral (oxígeno).
El átomo de nitrógeno tendrá una estructura piramidal triangular
en la que los vértices el triángulo de la base son los dos hidrógenos
y el oxígeno. Esta estructura piramidal está afectada por el par
de electrones no enlazante del nitrógeno.
Así mismo, el oxígeno, tiene también dos
pares de electrones no enlazantes lo que
hará que su enlace con el hidrógeno sea
angular.
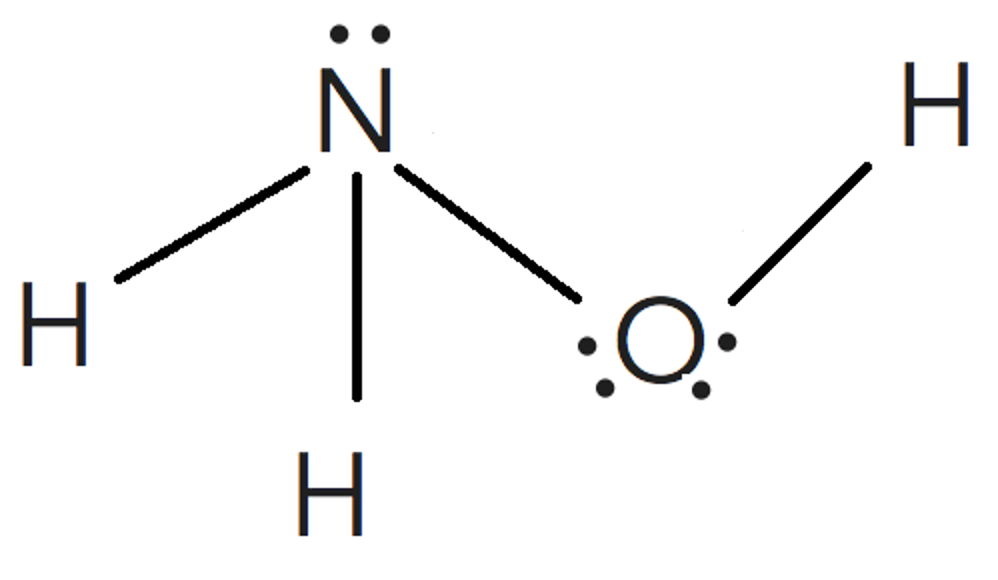

Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes

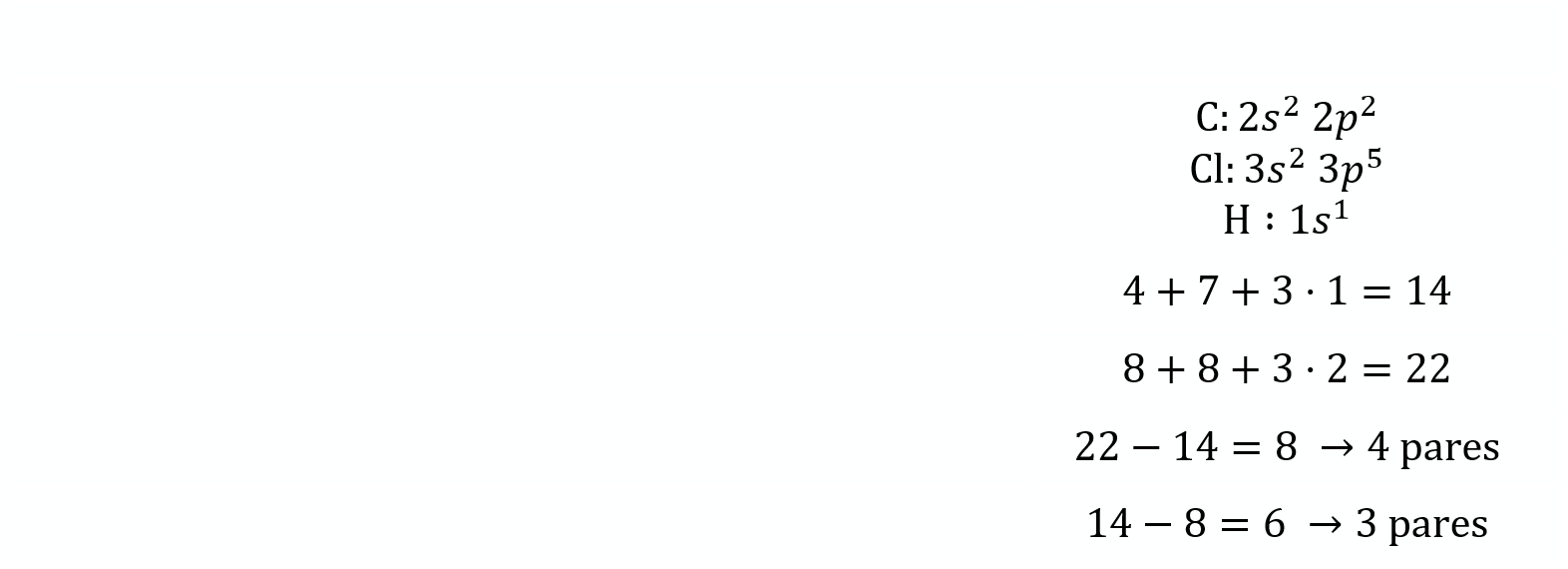
Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes

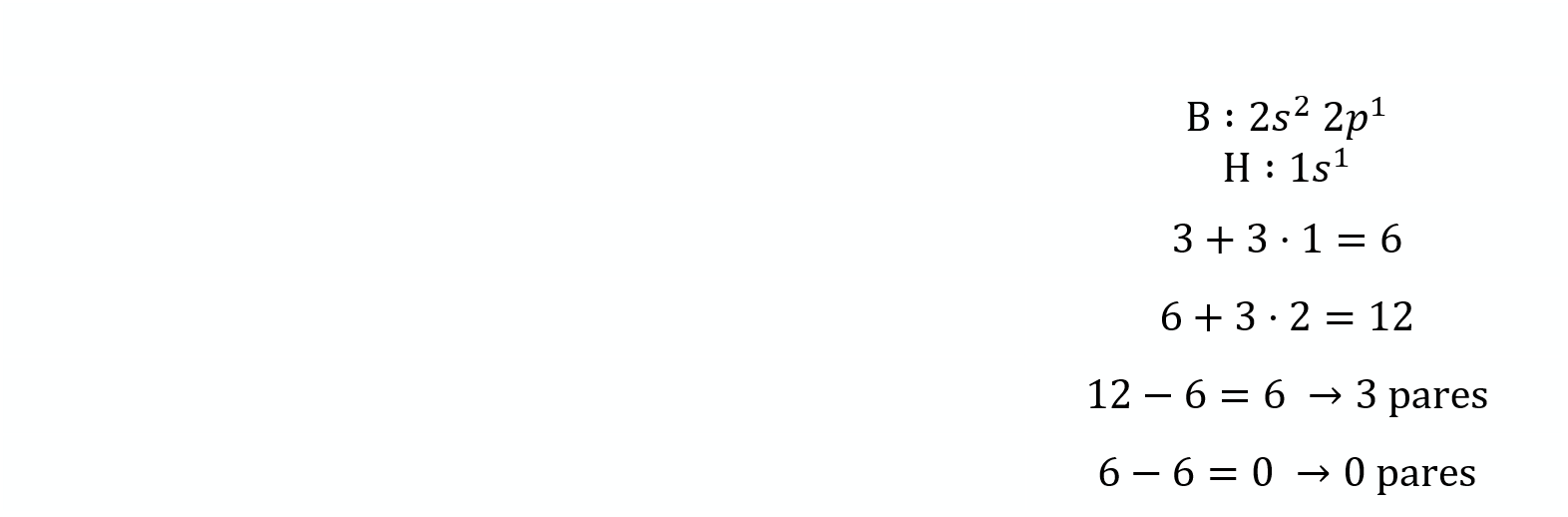
Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes
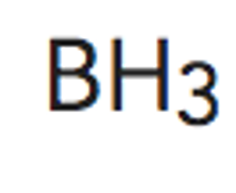
Paso 1. Cálculo de los pares de electrones enlazantes y no enlazantes.
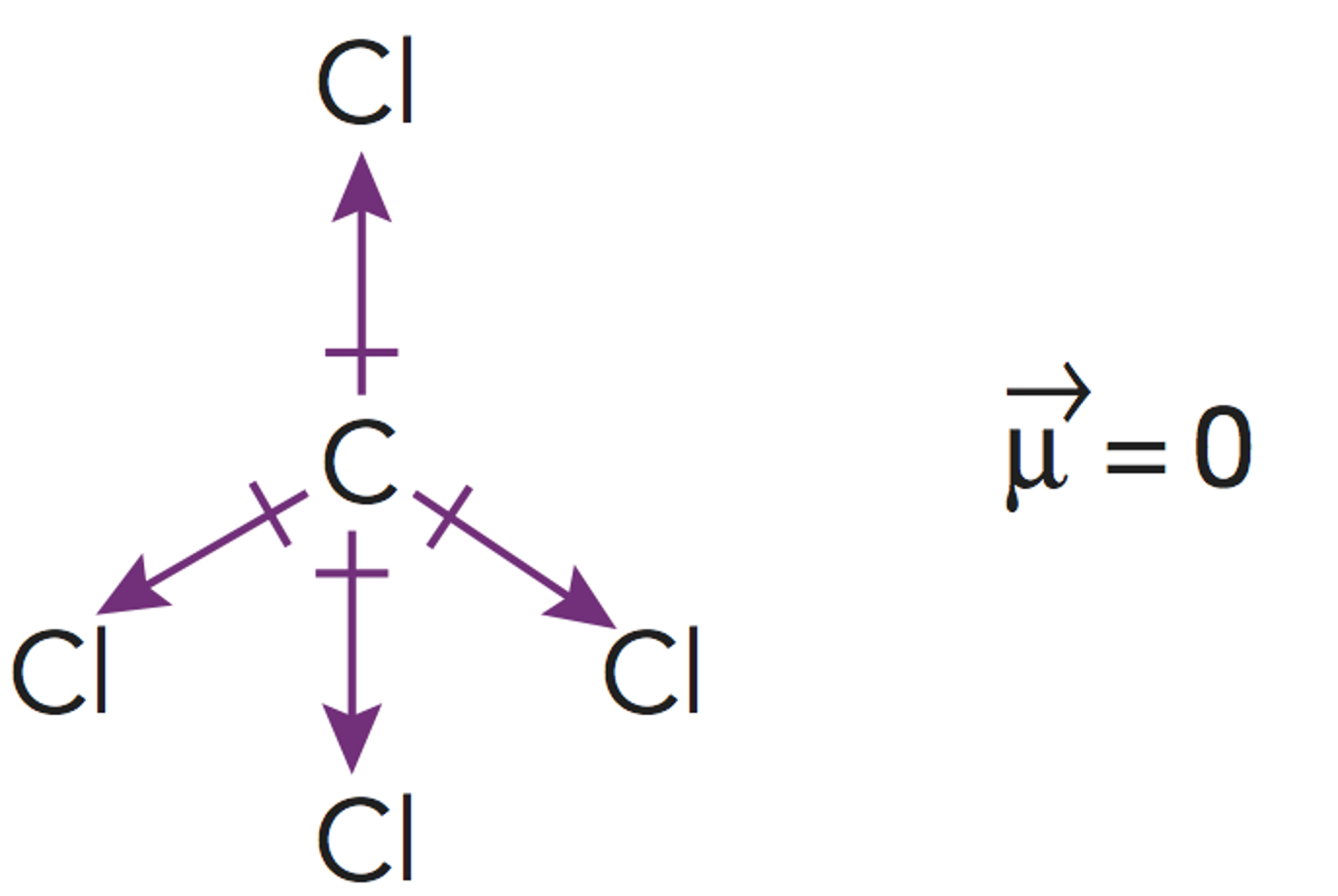
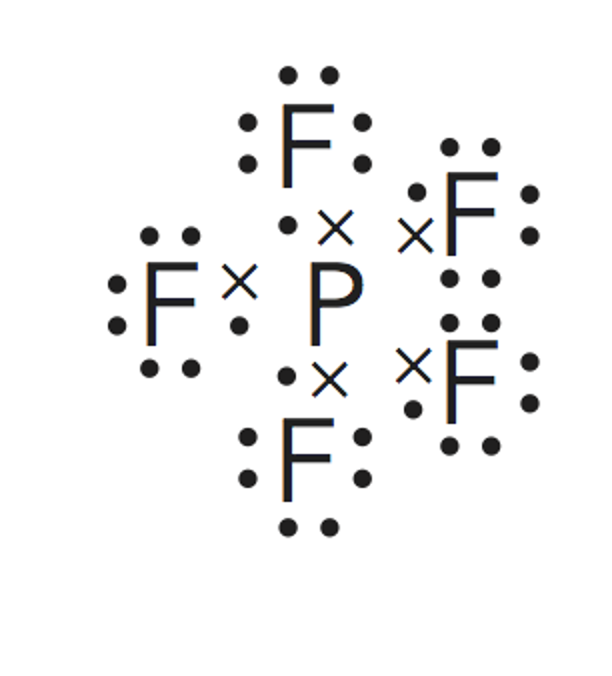
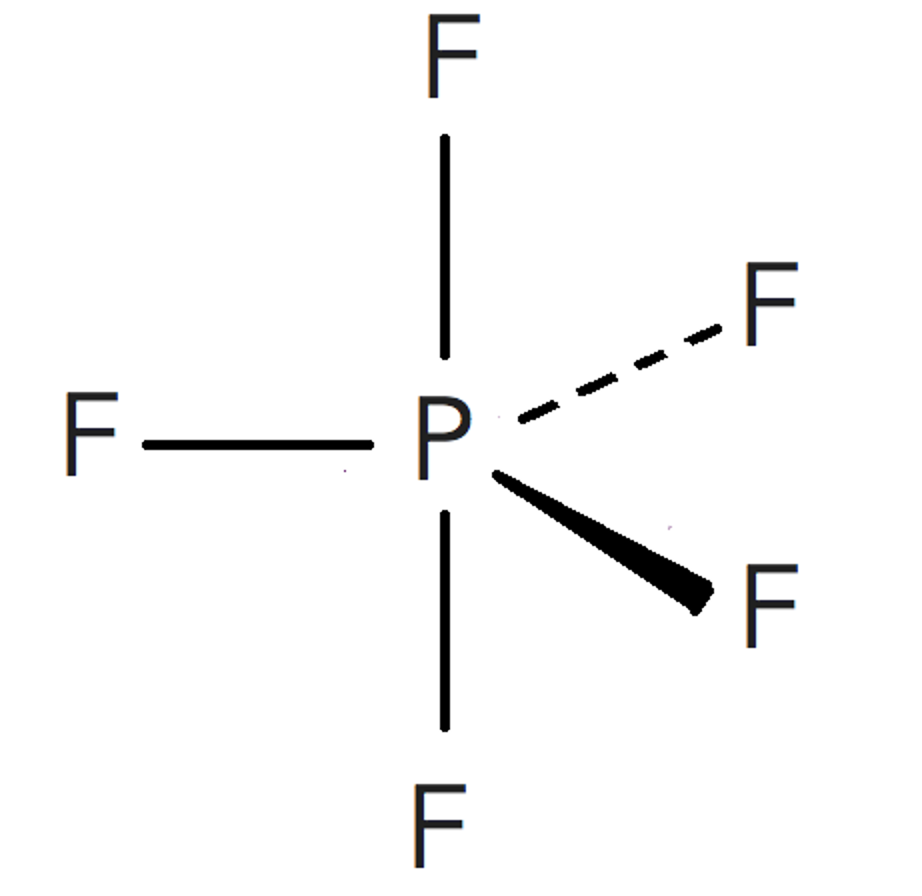
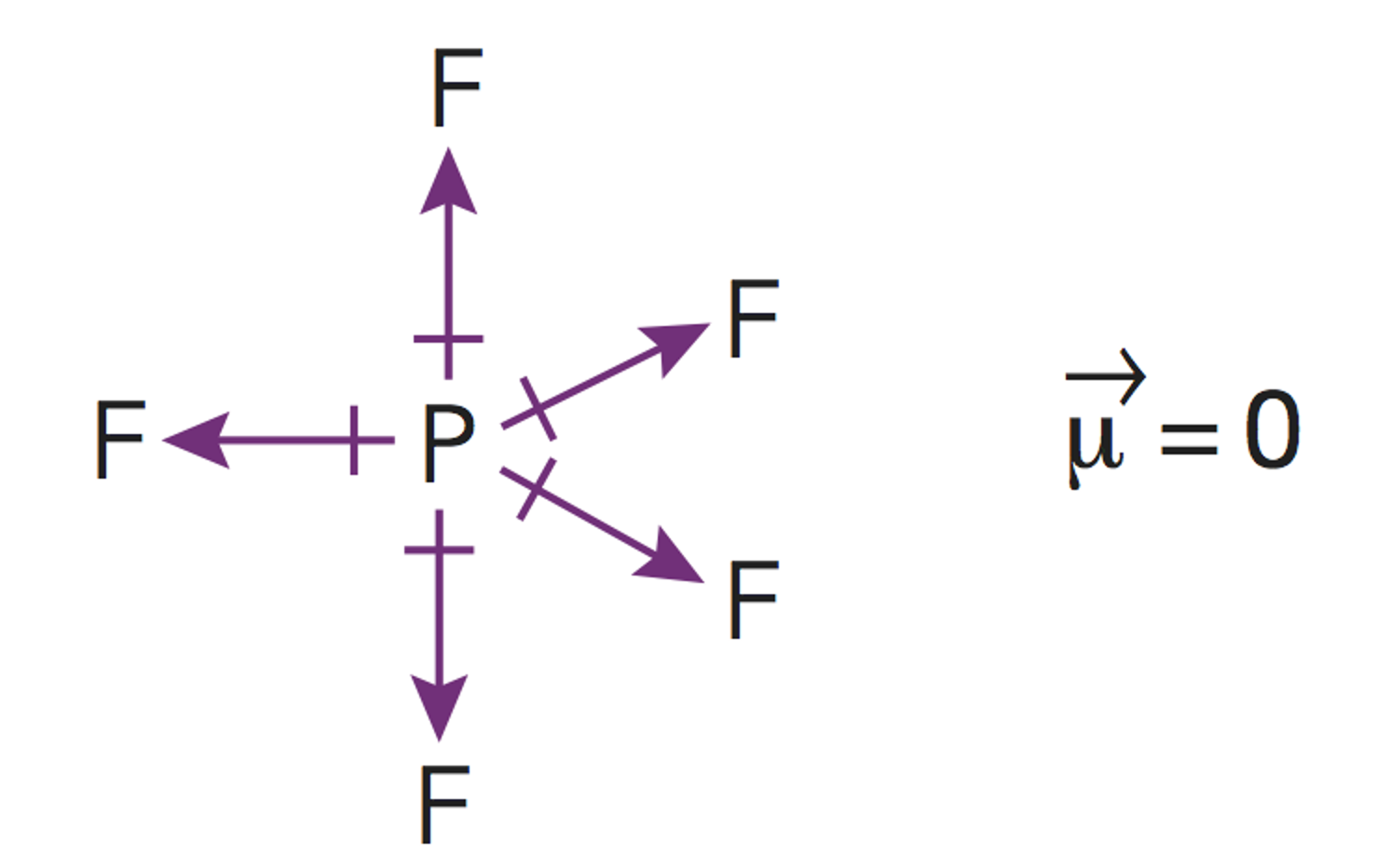
Este es un caso de la excepciones a la regla del octeto por exceso. Cuando los átomos se enlazan conelementos no metálicos del tercer periodo (capa de valencia n=3), como el fósforo o el azufre, puede suceder que serodeen de más de ocho electrones.
Esto es debido al hecho de que se hallan disponibles (energéticamente accesibles) los orbitales 3d de estosátomos, y por ello pueden albergar más de 8 electrones en su capa de valencia. Así, el fósforo, puede forma hasta 5enlaces covalentes, como en este caso.El cálculo de los pares enlazantes y no enlazantes deben hallarse a medidaque se dibuja la estructura de Lewis de la molécula.

Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia


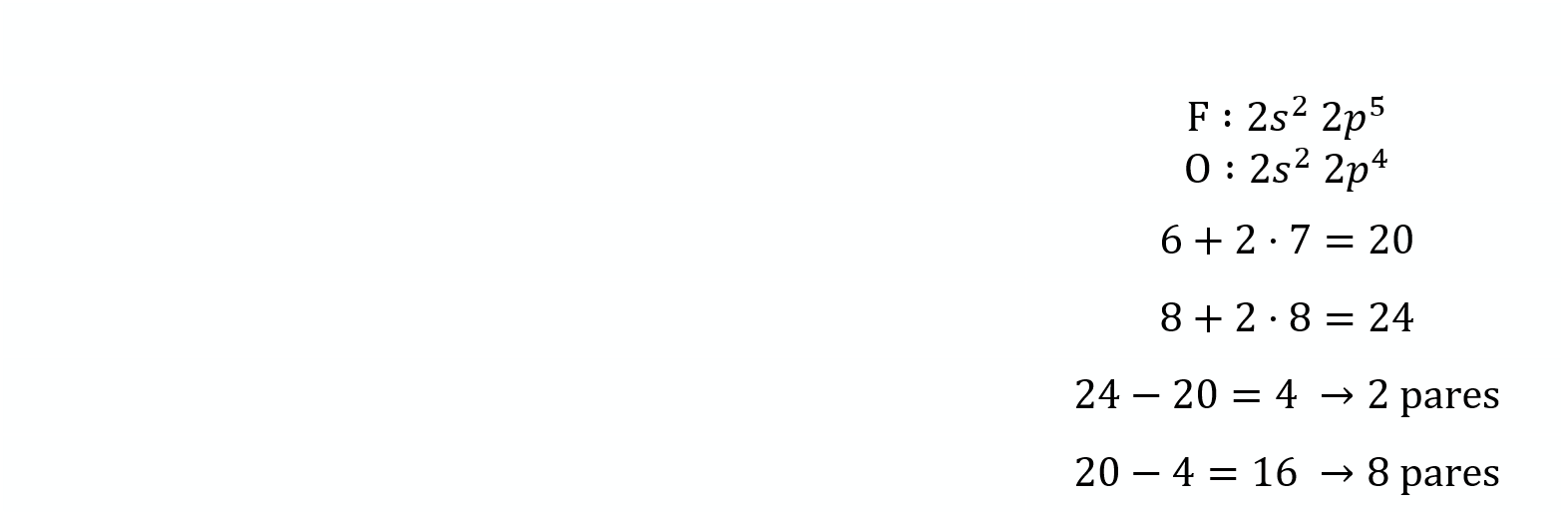
Configuración electrónica de la capa de valencia
Número de electrones de la capa de valencia
Número de electrones según la teoría del octeto
Pares enlazantes
Pares no enlazantes
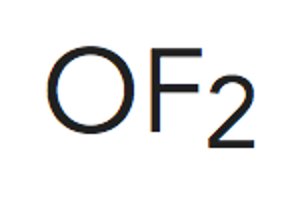
Paso 3. Obtener la representación de Lewis de la molécula.
Según predice la estructura de Lewis al existir 2 pares de electrones enlazantes se tiene unaestructura lineal para situar los átomos de flúor. No se tienen en cuenta los electrones libres en este caso.
Paso 4. Estudio de la geometría desde el punto de vista de la TRPECV.
La molécula de difluoruro de oxígeno, con dos pares de electrones libres alrededor del átomo central,tiene una estructura lineal se convierte en angular.