2 000
6 000
4 000
Presiónatmosférica(atm)
Diamante
Grafito
Líquido
Vapor
DIAGRAMA DE FASE
Se dice que un elemento presenta formas alotrópicas cuando puede adoptar diversas estructurasmoleculares en el mismo estado de agregación, cada una de las cuales presenta idénticas propiedades químicas, perodiferentes propiedades físicas.
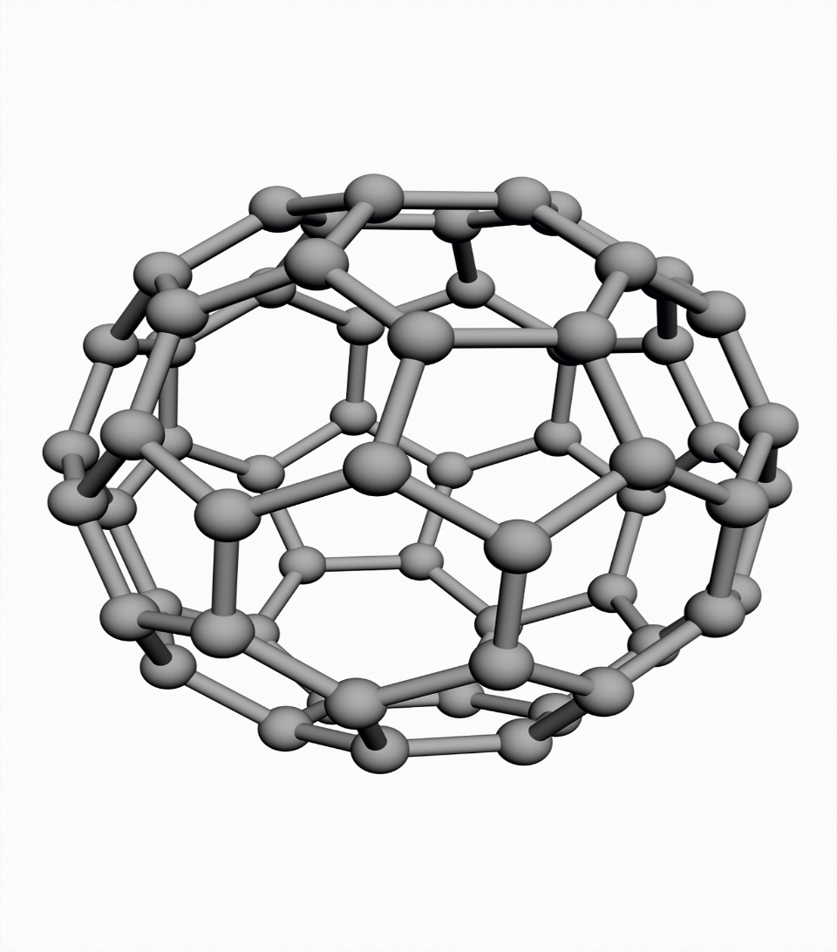
Para el caso del carbono se conocen cinco formas alotrópicas, además del carbono amorfo (carbón vegetal,coque, carbón animal, etc): grafito, diamante, fullerenos, nanotubos y carbinos.
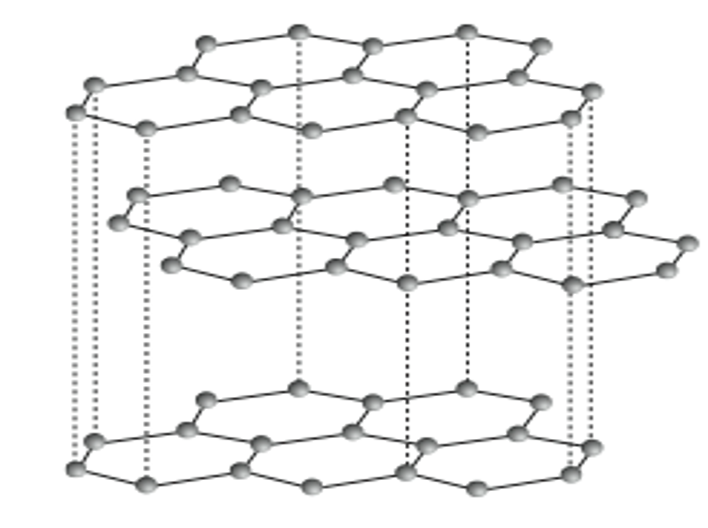
Una de las formas en las cuales se encuentra el carbono es el grafito se caracteriza porque los átomos decarbono se encuentran “en los vértices de hexágonos que tapizan un plano”, es de color negro, opaco y blando, es elmaterial del cual está hecha la parte interior de los lápices de madera. El grafito tiene exactamente los mismosátomos del diamante, pero por estar dispuestos en diferente forma tiene distintas propiedades físicas.
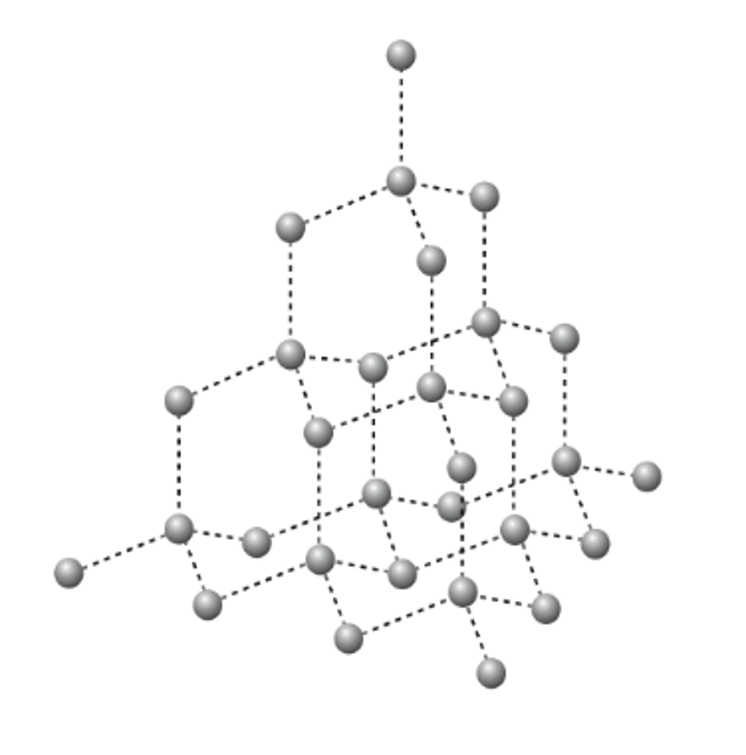
Los diamantes naturales se forman en lugares donde el carbono ha sido sometido a grandes presiones yaltas temperaturas, su estructura es tetraédrica, que da como resultado una red tridimensional, que, a diferencia delgrafito, tiene una grado de dureza alto. Los diamantes se pueden crear artificialmente, sometiendo el grafito atemperaturas y presiones muy altas. Debido a la estructura en capas el grafito es el único capaz de conducir lacorriente eléctrica.
Todos ellos son insolubles en prácticamente cualquier disolvente.